最近,我校化学生物学团队陈家良博士与南开大学苏循成教授合作在酶催化反应机制研究方面取得了重要进展,其相关工作发表于《ACS Catalysis》(中科院1区top期刊,影响因子12.9)。论文题目为:3D Structure of the Transient Intermediate of the Enzyme−Substrate Complex of Sortase A Reveals How Calcium Binding and Substrate Recognition Cooperate in Substrate Activation。

原子分辨率的三维结构对于理解蛋白质的结构、动力学以及功能至关重要。其中,蛋白酶与底物分子共价连接的催化反应中间体结构对于底物识别机制以及催化反应机理的理解尤为重要。然而,酶催化反应是非平衡态体系,真实的酶催化反应中间体在溶液中含量低、存在时间短,难以通过常规生物物理技术获得其高分辨的溶液三维结构。
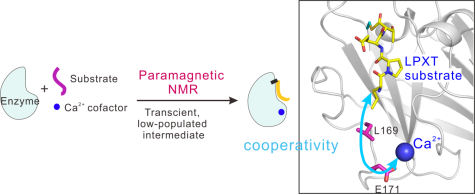
鉴于此,化学生物学团队陈家良博士与南开大学元素有机化学国家重点实验室苏循成教授以金黄色葡萄球菌分类酶sortase A(SrtA)为例,发展了结合位点特异性顺磁标记技术和选择性同位素标记方法解析短寿命酶催化中间体复合物结构的策略。该工作测定得到了溶液中分类酶SrtA在酶催化反应过程中不稳定的瞬时硫酯中间体复合物结构,阐释了SrtA与底物之间识别特异性的机理以及辅因子Ca2+在底物识别和催化过程中的协同作用机制(下图)。该方法有望应用于多种蛋白酶瞬态中间体的结构解析,进一步加深对蛋白制机器的底物识别机制与催化反应机理的理解。
化学生物学团队陈家良博士为论文的第一作者,南开大学苏循成教授为论文的通讯作者,南开大学为论文第一单位,枣庄学院为论文的第二单位。
文章链接网址:https://pubs.acs.org/doi/10.1021/acscatal.3c02214。
(文图/化学化工与材料科学学院 编辑/邵清清 审核/徐海波)